Research
欢迎来到桑格实验室和我们的研究兴趣. 真核生物对细胞事件(如分裂)的复杂调控, 发育和细菌感染涉及细胞骨架的剧烈重组. 了解这些结构重排所涉及的机制和众多蛋白质是我们研究的主要重点. 实验室目前正在进行的具体研究项目包括:
I. 鉴定微生物运动中涉及的蛋白质

View Sanger et al. (1996)
病原微生物(电影)协调多种宿主细胞骨架蛋白,以促进进入和扩散到其他宿主细胞. 使用的一种机制是基于肌动蛋白的运动性,它涉及肌动蛋白和其他肌动蛋白结合蛋白. 我们的实验室使用培养和原代细胞系统来定义和识别参与这些过程的大分子. 我们正在使用各种各样的技术, 包括光镊, 光漂白后荧光恢复(FRAP), 蛋白质生物化学, immunological, 以及延时视频显微镜来阐明相关的蛋白质和机制. (for more details...)
II. 检查肌原纤维形成过程中的细胞和分子级联事件
View Sanger et al. 1997. PNAS. 94:9493-9498
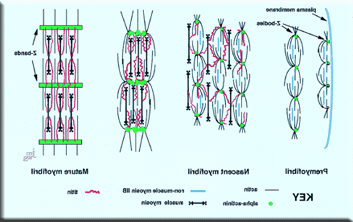
肌原纤维的形成涉及到多个亚基精确地排列成一个线性排列的肌节(分裂心肌细胞膜)。. 肌肉研究的挑战之一是描述细胞中粗细细丝和z带形成肌节和肌原纤维的组装过程中的步骤顺序。见骨骼和心脏肌节的对比图). 我们提出的肌原纤维前模型用于肌原纤维的发生(Rhee等).1994; Dabiri et al.1997)提出了一个三步机制:前肌原纤维到新生肌原纤维到成熟肌原纤维. 肌原纤维位于肌肉细胞的边缘. 这些前肌原纤维是由小锥体组成的.
在z -小体中,基本的小颗粒以α -肌动蛋白的肌肉特异性亚型的浓度为标志. 肌动蛋白丝的倒钩端嵌在z型体中. 肌动蛋白丝的尖端与非肌球蛋白IIB丝重叠并交叉. 新生肌原纤维的特征是重叠的厚肌球蛋白II丝和肌球蛋白丝. 在向成熟肌原纤维过渡的过程中, 肌球蛋白II丝排列成均匀的a带. 在从新生肌原纤维到成熟肌原纤维的转变过程中, 非肌凝蛋白IIB丝与肌凝蛋白II丝交换,z小体生长并融合成z带. z体最初表现为α -肌动蛋白的离散聚集体. 我们正在使用各种分子和生化技术来阐明蛋白质相互作用及其机制. (further details....)
III. Cytokinesis

View Sanger & Sanger, 2000, Mic. and Tech. 49:190-201.
细胞的形状和有丝分裂纺锤体的位置影响细胞骨架蛋白在卵裂沟形成过程中的沉积。. 在有两个纺锤体的细胞中, 收缩蛋白不仅被招募到与前中期板相邻的皮层,而且也被招募到每对相邻的非子极或中心体之间的皮层. 在这些培养的PtK2细胞中,相邻两极之间的沟壑与Rappaport(1961)观察到的沟壑相似, J Exp Zool 148:81-89),当棘皮动物的卵被操纵成一个环形,使两个有丝分裂纺锤体的两极彼此相邻时. 这些对注射组织培养细胞的观察表明,脊椎动物细胞与棘皮动物细胞具有共同的卵裂沟形成机制. (further detail....)
